胆道恶性肿瘤转化治疗专家共识(2025)
2025 - 04 - 25
来源:

本文内容已经过同行评议,以优先出版方式在线发表,可作为有效引用数据。由于优先发表的内容尚未完成规范的编校流程,《中华外科杂志》不保证其数据与正式版内容的完全一致。
【引用本文】中华医学会外科学分会胆道外科学组, 中国医师协会外科医师分会胆道外科专家工作组. 胆道恶性肿瘤转化治疗专家共识(2025)[J]. 中华外科杂志, 2025, 63(6): 453-460. DOI: 10.3760/cma.j.cn112139-20250310-00118.
胆道恶性肿瘤转化治疗专家共识(2025)
中华医学会外科学分会胆道外科学组
中国医师协会外科医师分会胆道外科专家工作组

检索策略
证据等级及推荐强度说明
共识正文
一、BTC的转化治疗现状
二、BTC转化治疗模式
三、BTC转化治疗适用人群
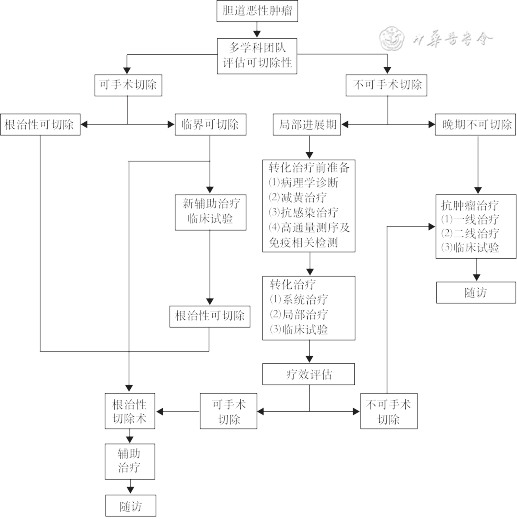
四、BTC转化治疗前准备
五、BTC转化治疗方案
六、BTC转化治疗效果的评估
七、未获得成功转化患者的后续治疗
八、BTC转化成功后的手术治疗
九、BTC转化手术后的辅助治疗
《胆道恶性肿瘤转化治疗专家共识(2025)》编审工作组成员
文章转载自中华外科杂志编辑部
返回上级
